

MAST3基因属于微管相关丝氨酸/苏氨酸激酶(MAST)家族的一员,在人类大脑皮层中选择性表达,介导重要的神经元功能,例如神经元存活、神经突生长等。MAST家族的蛋白质结构保守性体现在:均具有一个中央微管相关丝氨酸-苏氨酸激酶(STK)结构域以及侧翼分布的功能不明(DUF)保守结构域。MAST家族仅发现MAST1有明确相关遗传病(巨型胼胝体综合征伴小脑发育不全和皮质畸形),MAST2-4 缺陷致病的案例报道极其罕见。
该现象的潜在原因可能是,MAST3基因缺陷并不导致显著的临床表型,或者MAST3基因缺陷致病案例本身十分罕见,且由于缺少对相关疾病的认知,在一些临床基因检测中没有作为候选基因(例如基因Panel)而被漏诊。从MAST3蛋白主要在大脑皮层中表达以及MAST1基因与脑发育障碍相关性的实例来看,后者更可能是目前对MAST3基因相关疾病缺乏认知的原因。
湖南省妇幼保健毛翛副研究员、王华教授团队长期专注研究神经发育障碍疾病,并一直在寻找潜在的MAST3基因相关病例。在联合国内多家研究中心的几千例患者全外显子组测序(WES)数据进行聚类分析后,发现了一共4例携带MAST3基因新发(de novo)变异的患者(2例源自智因大数据)。
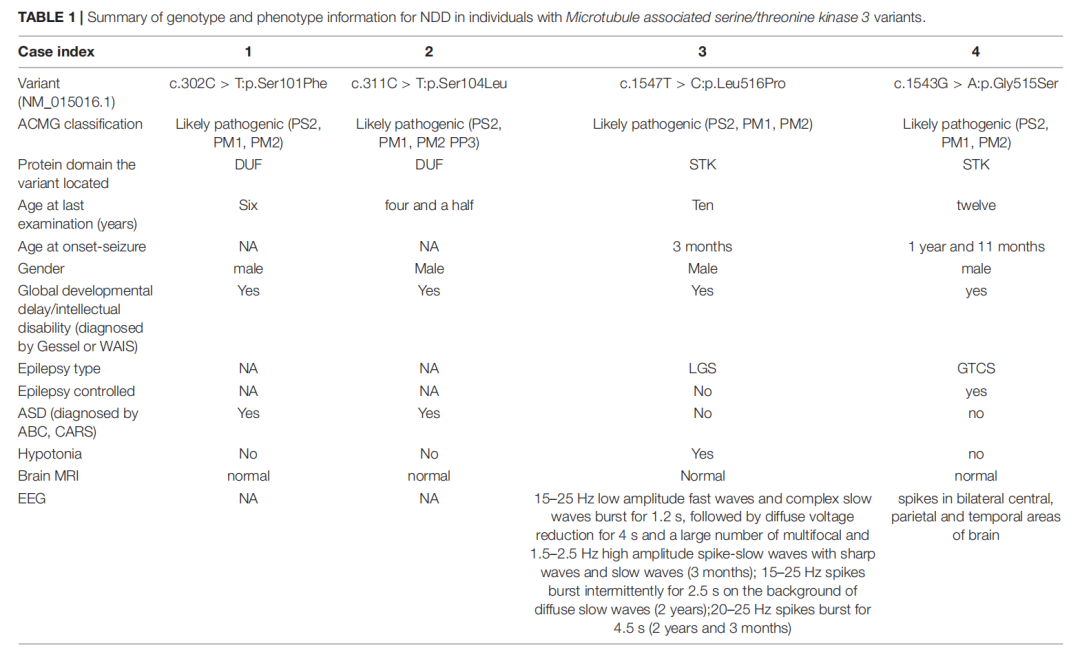
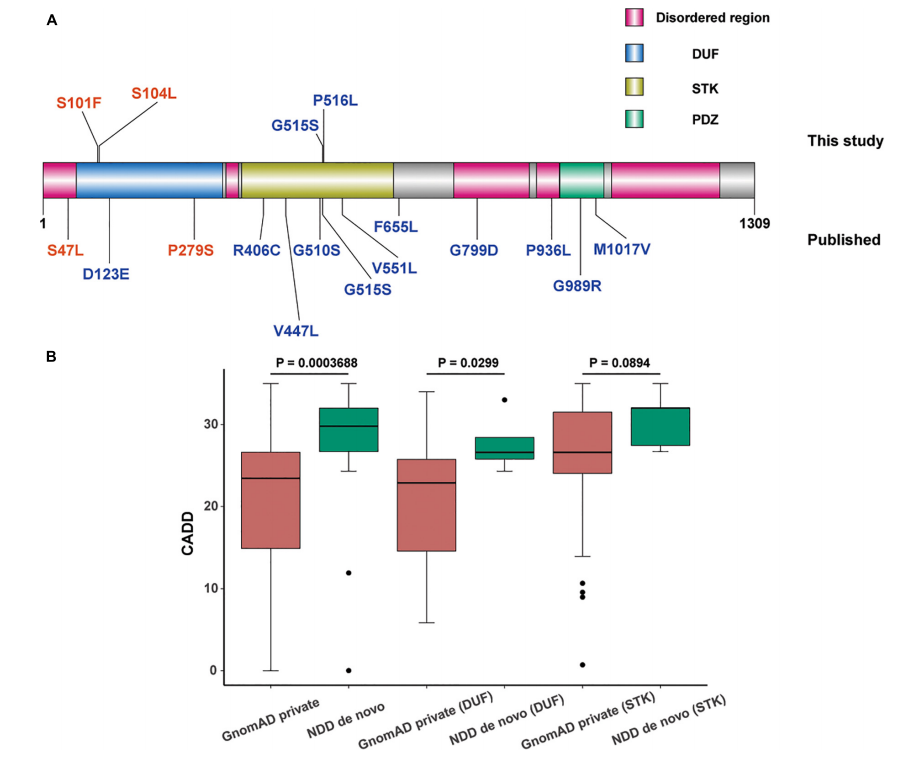
在比对4名患者变异数据后,一个有意思的现象被发现:4名患者携带的变异分别位于MAST3蛋白的DUF和STK结构域上,且不同表型对应的变异所在结构域不同。研究者通过列举MAST3基因所有已知变异及所在结构域(图1),推测MAST3变异所在结构域与表型特征可能存在某种对应关系:DUF结构域与ASD表型相关,STK结构域与DEE表型相关。
为了进一步证实这种猜想,研究者进行不同队列模型的生信数据统计(图1)。筛选ASD队列进行与gnomAD数据库携带样本比对时,发现位于DUF结构域的错义突变过量富集;类似地,筛选DEE队列与gnomAD样本比对,发现位于STK结构域上的变异显著富集。这一结果也支持了临床发现。
至此,研究者除了发现多个新的MAST3相关案例,还鉴定了与变异所在结构域存在关联的两种主要临床表型:以ASD为核心表型的NDD与以DEE为核心表型的NDD。
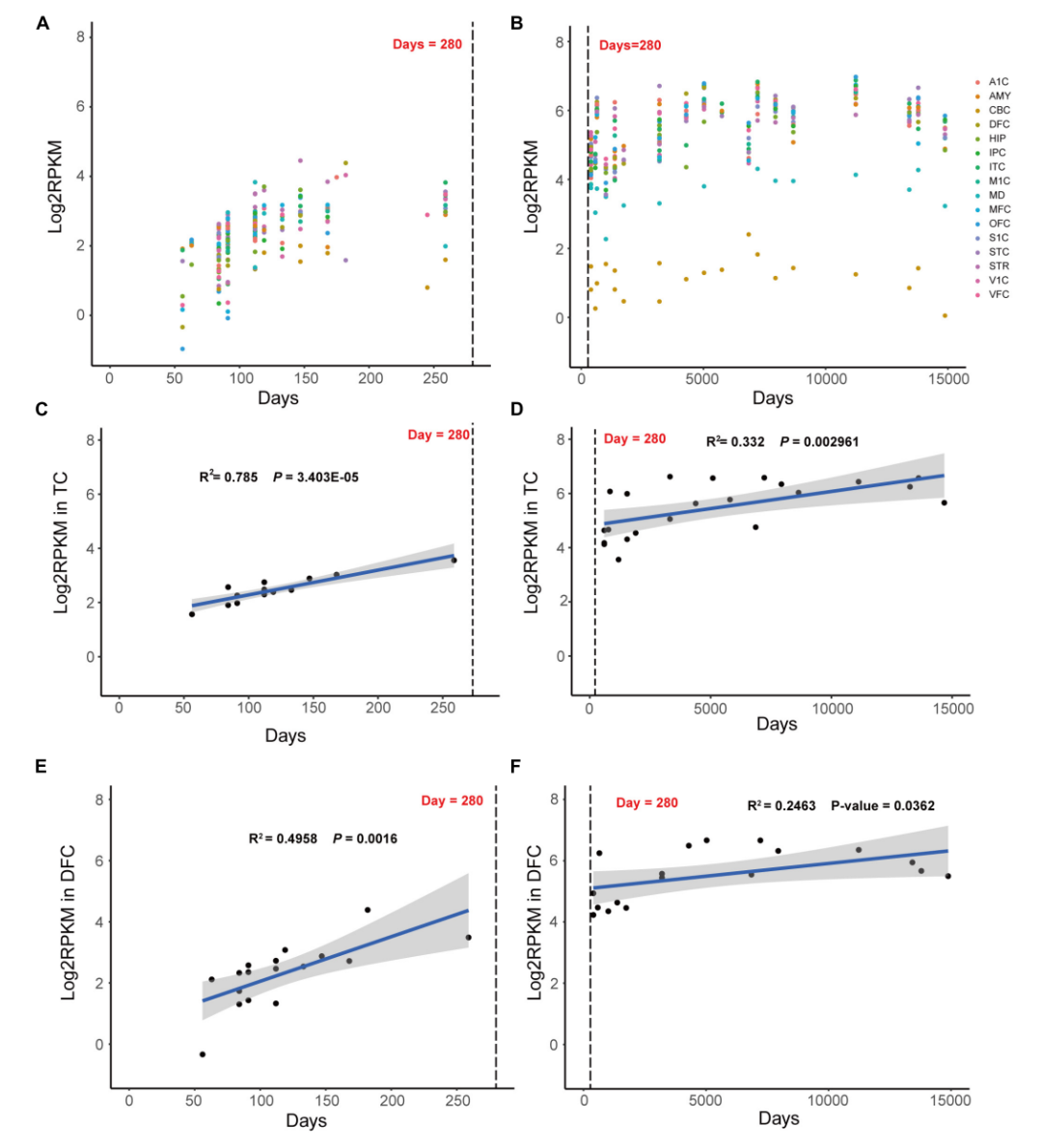
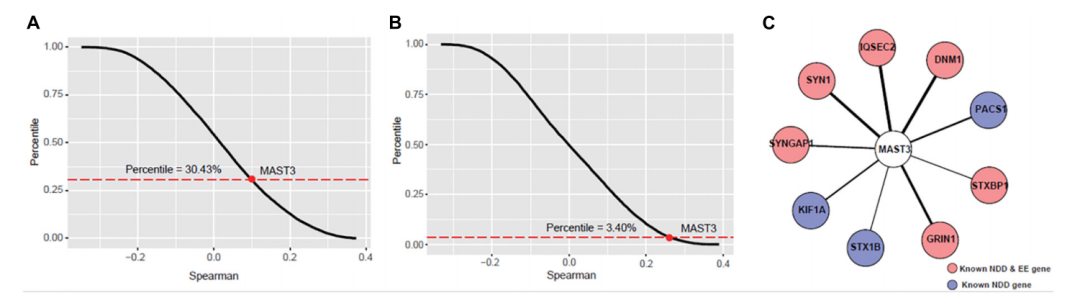
研究者通过BrainSpan转录组数据库和STRING蛋白互作数据库,首先确认了MAST3基因主要在人胚胎发育时期高表达(图2),并且发现其与DEE/NDD疾病基因存在共表达趋势。其中,MAST3基因与多个DEE/NDD基因同时存在相互作用(图3)。
除此之外,研究者还进行了MAST3 功能的体内实验——斑马鱼模型(图4),发现了MAST3 缺陷对大脑发育的影响。结果表明,与人类一样,斑马鱼mast3a/b对大脑发育和神经元功能至关重要。
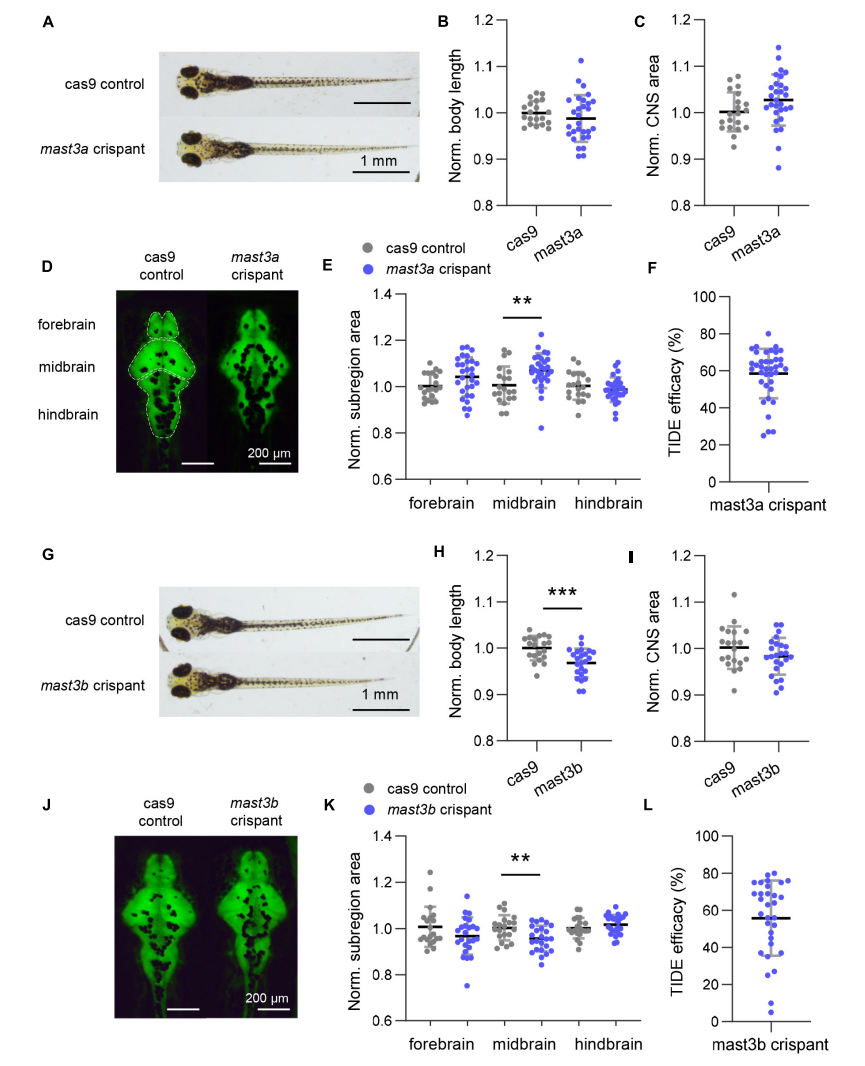
综上,研究团队首次总结了NDD中MAST3基因的基因型与表型的相关性:DUF结构域的变异导致具有以ASD为核心表型的NDD,而STK结构域的变异导致具有以癫痫为核心表型的NDD。

结 语


